Istmocele
Istmocele
redatto da Dr. P.Parisella
Il termine Istmocele si riferisce alla presenza di una nicchia in sede di cicatrice da taglio cesareo o più recentemente anche di miomectomie eseguite a livello del tratto istmico anteriore. La gran parte (83%) degli autori definisce l'istmocele come una rientranza o nicchia in sede di cicatrice da taglio cesareo con una profondità di almeno 2 mm.
Negli ultimi decenni la percentuale di TC è aumentata nella maggior parte dei paesi occidentali con una incidenza variabile dal 6,2% al 36% con conseguente aumento dell'incidenza di istmocele che si ha in circa il 56% delle donne con una storia di pregresso taglio cesareo.
Eziopatogenesi
L'eziopatogenesi non è ancora ben definita; le varie ipotesi avanzate fanno pensare che possa essere di tipo multifattoriale:
1.Una incisione eseguita troppo in basso può comportare l'inclusione di tessuto cervicale contenente ghiandole che producono muco il quale potrebbe ostacolare il processo di cicatrizzazione con conseguente formazione della nicchia (Osser OV, 2010 - Vervoort AJ, 2015).
2.l'istmocele è stato osservato nei due terzi superiori della cervice in donne con TC di elezione mentre nel caso di TC eseguiti dopo dilatazione cervicale la nicchia era nella parte inferiore del canale cervicale (Raimondo G., 2015).
3.La formazione di aderenze tra la cicatrice da taglio cesareo e parete addominale in utero retroflesso, mediante la retrazione del tessuto cicatriziale che attira la cicatrice uterina verso la parete addominale possono indurre lo sviluppo della nicchia (Vervoort AJ, 2015).
4.Altri studi hanno messo a confronto la sutura a singolo strato con la sutura a doppio strato (Bij de Vaate AJ, 2014 - Vervoort AJ, 2015) ma non hanno osservato differenze significative in termini di incidenza di difetti della parete uterina tra i due metodi chirurgici (Bij de Vaate AJ, 2014 -Vervoort AJ, 2015 - Roberge S, 2014); in un'altro studio (Di Spiezio Sardo A, 2017) è stato osservato che la chiusura a doppio strato è associata ad un maggiore spessore miometriale residuo a 3 mesi post-intervento ma non ha comunque rilevato alcuna differenza tra le due metodiche chirurgiche.
5. E' stato descritto un aumento dello sviluppo dell'istmocele in caso di TC effettuato con dilatazione cervicale superiore a 5 cm o dopo una durata del travaglio superiore a 5 ore. (Vikhareva Osser O, 2010)
6. numero di tagli cesarei. In caso di più tagli cesarei il segmento uterino inferiore presenta un maggior punto di debolezza con conseguente maggior rischio di anomala cicatrizzazione (Wang C.B., 2009); Lo spessore del miometrio a livello dell'istmo diminuisce con l'aumento del numero di TC per cui il segmento uterino inferiore risulta più debole con conseguente maggior rischio di difetto di cicatrizzazione (Florio P., 2012); i margini dell'incisione presentano uno spessore diverso (margine superiore più spesso di quello inferiore) e questa differenza aumenta col numero di tagli cesarei: ciò può contribuire allo sviluppo di difetti anatomici del segmento inferiore (Hayakawa H., 2006).
7. fattore di rischio individuale: esistono differenze individuali nella guarigione delle ferite (Vervoort AJ, 2015) o condizioni legate al paziente che possono predisporre alla formazione dell'istmocele come utero retroflesso, TC multipli, ipertensione (Bij de Vaate AJ, 2014 - VervoortAJ, 2015). Probabilmente anche una predisposizione genetica individuale insieme ad altri fattori sconosciuti potrebbe essere la causa di questa patologia (Iannone P., 2019).
Diagnosi Ecografica
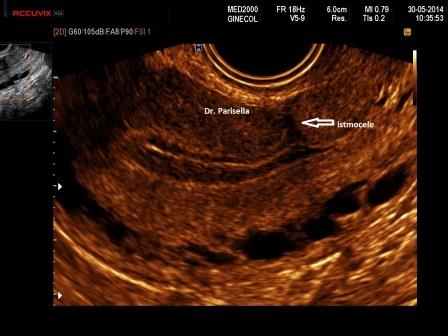
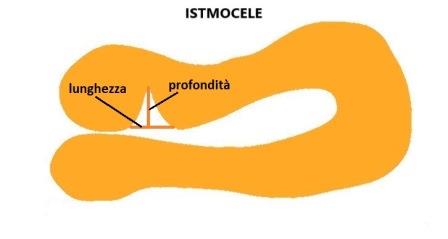
La diagnosi ecografica, essenzialmente effettuata con ecografia transvaginale, anche se in alcuni casi, specialmente nella visualizzazione di eventuali complicanze l'approccio sovrapubico può essere di aiuto ( ndr ), si basa sul riscontro di un'area ecopriva, di profondità almeno 2 mm., più frequentemente a forma triangolare, con apice rivolto verso la parete anteriore dell'utero e base che si continua con la cavità endometriale, localizzata in regione cervico-istmica a livello della cicatrice da pregresso taglio cesareo ( Fig. 1 ).
Per quanto riguarda la forma della nicchia la classificazione di de Vaate ( Bij de Vaate AJM et al. Ultrasound Obstet Gynecol 2010) prevede varie forme: triangolo, semicerchio, rettangolo, cerchio, goccia, cisti da inclusione ( Fig 2 ).
Tali aspetti possono essere meglio visualizzati se l'ecografia viene effettuata a metà ciclo quando l'ecopattern endometriale è di tipo trilaminare. Le forme più frequenti sono quelle triangolari e semicircolari.
Nello stesso lavoro è riportata la tecnica di misurazione della profondità dell'istmocele (1), dello spessore del miometrio residuo (2) e dello spessore totale del miometrio adiacente al difetto (3). Fig.3
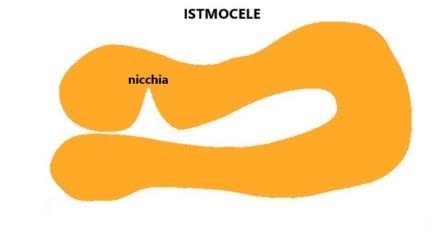
Un altro lavoro (Jordans IPM et al. Sonographic examination of uterine niche in non?pregnant women: a modified Delphi procedure. Ult.Ob.Gyn.2018; 53 (1):107-115.) detta le basi sulle modalità di misurazione dell'istmocele e classifica la nicchia in tre forme: nicchia semplice, nicchia semplice con un ramo, nicchia complessa (con più rami).
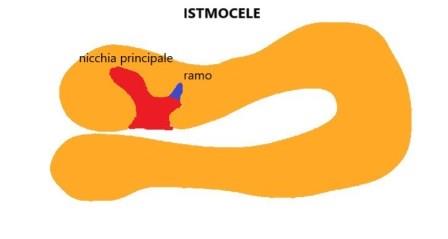
Un ramo viene definito come una porzione più sottile della nicchia principale, diretto verso la sierosa e di larghezza inferiore alla nicchia principale e deve essere sempre descritto.
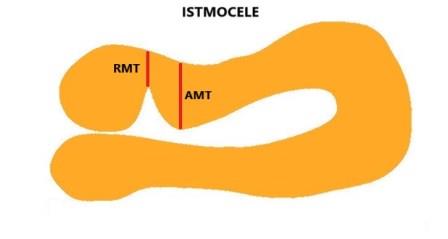
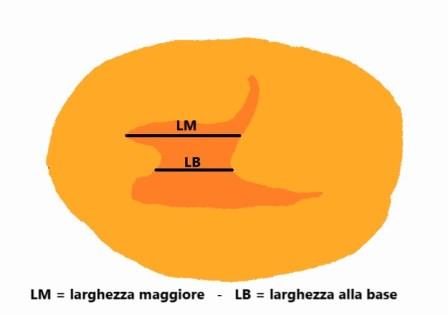
Le misurazioni della lunghezza e della profondità della nicchia, lo spessore del miometrio all'apice della nicchia (RMT) e lo spessore del miometrio adiacente alla nicchia (AMT) devono essere effettuate in scansione sagittale con una buona visualizzazione del canale cervicale e del miometrio ma non dell'endometrio che non deve far parte delle misurazioni; la RMT deve essere misurata dove lo spessore è minore. Se la nicchia ha una forma tale che la lunghezza alla base è minore di quella in altro punto bisogna misurare entrambe le lunghezze: lunghezza maggiore e lunghezza alla base.
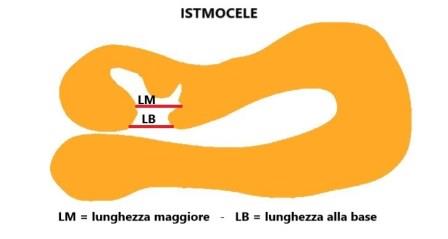
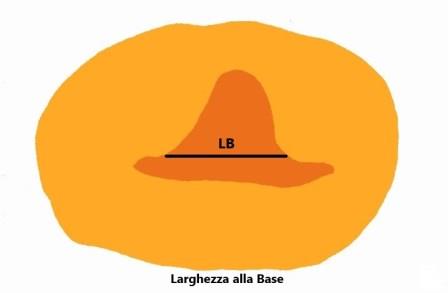
La larghezza della nicchia deve essere misurata in scansione assiale: anche qui, come per la lunghezza, deve essere misurata sia la larghezza maggiore che la larghezza alla base della nicchia (se alla base vi è la larghezza maggiore si misura solo quella). Solo queste misure, definite di base, sono considerate essenziali.
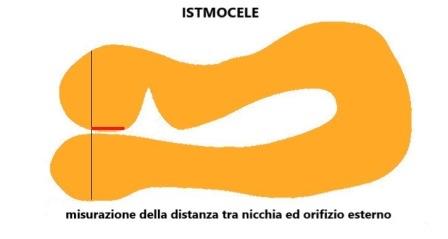
Le altre misure, cioè la distanza tra nicchia e piega vescico-vaginale e la distanza tra nicchia e orifizio esterno sono considerate come un valore aggiunto per la pianificazione di future strategie chirurgiche e per la ricerca, ma non per la valutazione di base dell'istmocele (Jordans IPM et al, 2018 ).
I vari Esperti cha hanno partecipato al lavoro di Jordans IPM concordano sul fatto che la valutazione della nicchia con l'infusione di gel o soluzione salina (Sonoisterografia), che si estende nel difetto del miometrio rendendolo meglio visibile, è di valore aggiuntivo rispetto all'utilizzo dell'ecografia 2D standard, ma non è stata espressa alcuna preferenza tra l'una e l'altra metodica.
Allo stato non vi è un consenso unanime in merito al gold standard per il rilevamento e la misurazione dell'istmocele ma le metodiche più utilizzate sono l'Ecografia Transvaginale e l'Isteroscopia.
Nella classificazione della gravità clinica dell'istmocele alcuni Autori valutano solo lo spessore del miometrio misurato all'apice dell'istmocele (RMT) per cui la gravità del difetto è tanto maggiore quanto minore è lo spessore del miometrio residuo. Altri (Tower AM, 2013) valutano il rapporto tra lo spessore del miometrio residuo misurato all'apice dell'istmocele e spessore del miometrio adiacente all'istmocele (RMT/RMA).
SINTOMI E COMPLICANZE
L'istmocele può essere associato a sintomi clinici (Morris H.,1995); il sintomo caratteristico è un sanguinamento uterino anomalo, cioè uno spotting postmestruale (Tower AM, 2013 - Setubal A, 2018), a volte associato a sintomatologia dolorosa, specie in caso di complicanze. La prevalenza di questo sintomo nei vari studi varia tra il 29% e l'82% e sembra che esista una correlazione tra sintomo e grandezza del difetto (Fabres C.,2003 - Tulandi T., 2016 - Setubal A, 2018 ). Il meccanismo del sanguinamento può essere legato al ristagno di sangue nella nicchia per poi essere rilasciato lentamente nei giorni successivi alle mestruazioni (Tower AM, 2013) oppure derivare da una ridotta contrattilità dell'utero nell'area della cicatrice (Thurmond AS, 1999). Altri sintomi sono la dismenorrea e il dolore pelvico che possono essere legati alla dimensione del difetto (Morris H.,1995) o alla presenza di complicanze come la rottuta d'utero (ndr) o alla presenza di contratture anomale per svuotare il contenuto dell'istmocele (Tower AM, 2013 - Setubal A, 2018 ).
Una importante complicanza dell'istmocele può essere l'infertilità legata a vari fattori come la persistenza di sangue mestruale nella nicchia che può alterare il muco cervicale e la motilità degli spermatozoi (Bij de Vaate AJ, 2014 - Setubal A, 2018) o può provocare uno stato infiammatorio cronico che può a sua volta influenzare la fertilità (Tower AM, 2013 ).
Altra complicanza è la gravidanza ectopica per impianto del sacco gestazionale sulla cicatrice; con lo sviluppo della gravidanza le pareti uterine a livello dell'istmocele potrebbero cedere con conseguente rottura d'utero (Tower AM, 2013 - Setubal A, 2018 ).
Anche se raramente il ristagno di sangue e muco potrebbe portare alla formazione di un ascesso (Diaz-Garcia C, 2009).
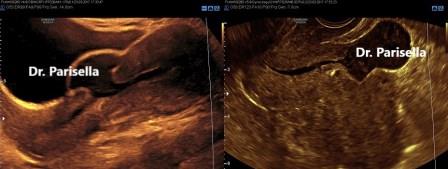
Altrettanto rara è la rottura d'utero fuori gravidanza descritta per quegli istmoceli impiantati su un utero retroverso (Fiaschetti V, 2015) (ndr).
Nell'immagine sottostante si evidenzia una rottura d'utero fuori gravidanza: a sinistra con approccio sovrapubico, grazie al contrasto della vescica, l'immagine è facilmente interpretabile; a destra con sonda transvaginale l'immagine è meno suggestiva.
Bibliografia
Armstrong V, Hansen WF, Van Voorhis BJ, Syrop CH. Detection of Cesarean scars by transvaginal ultrasound. Obstet Gynecol 2003; 101: 6165.
Belinda Centeio L. et al. Findings in patient with postmenstrual spotting with prior section. Journal of Minimally Invasive Gynecology. 2010;17:361-364.
Bij de Vaate AJM, Brölmann HAM, Van der Slikke JW, Emanuel MH, Huirne JAF. Gel instillation sonohysterography (GIS) and saline contrast sonohysterography (SCSH): comparison of two diagnostic techniques. Ultrasound Obstet Gynecol 2010; 35: 486489.
Bij de Vaate AJ, Brolmann HA, van der Voet LF, van der Slikke JW, Veersema S, Huirne JA. Ultrasound evaluation of the Cesarean scar: relation between a niche and postmenstrual spotting. Ultrasound Obstet Gynecol 2011; 37: 9399.
Bij de Vaate AJ, van der Voet LF, Naji O. , et al. Prevalence, potential risk factors for development and symptoms related to the presence of uterine niches following Cesarean section: systematic review. Ultrasound Obstet Gynecol 2014; 43 (04) 372-382
Borges LM, Scapinelli A, de Baptista Depes D, Lippi UG, Coelho Lopes RG. Findings in patients with postmenstrual spotting with prior cesarean Section. J Minim Invasive Gynecol 2010; 17: 361364.
Ceci O, Cantatore C, Scioscia M, Nardelli C, Ravi M, Vimercati A, Bettocchi S. Ultrasonographic and hysteroscopic outcomes of uterine scar healing after cesarean section: comparison of two types of single?layer suture. J Obstet Gynaecol Res 2012; 38: 13021307.
Chang Y, Tsai EM, Long CY, Lee CL, Kay N. Resectoscopic treatment combined with sonohysterographic evaluation of women with postmenstrual bleeding as a result of previous cesarean delivery scar defects. Am J Obstet Gynecol 2009; 200: 370.e14.
Chen HY, Chen SJ, Hsieh FJ. Observation of cesarean section scar by transvaginal ultrasonography. Ultrasound Med Biol 1990; 16: 443447.
Diaz-Garcia C, Estellés JG, Escrivá AM, Mora JJ, Torregrosa RR, Sancho JM. Scar abscess six years after cesarean section: Laparoscopic and hysteroscopic management. J Minim Invasive Gynecol 2009; 16 (06) 785-788
Diaz SD, Jones JE, Seryakov M, Mann WJ. Uterine rupture and dehiscence: tenyear review and casecontrol study. South Med J 2002; 95: 431435.
Di Spiezio Sardo A, Saccone G, McCurdy R, Bujold E, Bifulco G, Berghella V. Risk of Cesarean scar defect following single- vs double-layer uterine closure: systematic review and meta-analysis of randomized controlled trials. Ultrasound Obstet Gynecol 2017; 50 (05) 578-583.
ElMazny A, AbouSalem N, ElKhayat W, Farouk A. Diagnostic correlation between sonohysterography and hysteroscopy in the assessment of uterine cavity after cesarean section. Middle East Fertil Soc J 2011; 16: 7276.
Fabres C, Aviles G, De La Jara C. , et al. The cesarean delivery scar pouch: clinical implications and diagnostic correlation between transvaginal sonography and hysteroscopy. J Ultrasound Med 2003; 22 (07) 695-700, quiz 701702
Fiaschetti V, Massaccesi M, Fornari M, Nezzo M, Da Ros V, Sorrenti G, Simonetti G. Isthmocele in a retroflexed uterus: a report of an unrecognized case. Clin Exp Obstet Gynecol. 2015;42(5):705-7.
Florio P, Filippeschi M, Moncini I, Marra E, Franchini M, Gubbini G. Hysteroscopic treatment of the cesarean-induced isthmocele in restoring infertility. Curr Opin Obstet Gynecol 2012; 24 (03) 180-186.
Ganovska A, Kovachev S. Uterine scar defect in women after cesarean section Ultrasound and Hysteroscopic diagnosi. Akush Ginekol (Sofiia). 2016;55 Suppl 2:9-14. Bulgarian.
Glavind J, Madsen L, Uldbjerg N, Dueholm M. Ultrasound evaluation of Cesarean scar after single and doublelayer uterotomy closure: a cohort study. Ultrasound Obstet Gynecol 2013; 42: 207212.
Gurol-Urganci I et al. Impact of cesarean section on subsequent fertility: a systematic review and meta-analysis.Hum Reprod. 2013 May3.
Hayakawa H, Itakura A, Mitsui T, Okada M, Suzuki M, Tamakoshi K, Kikkawa F. Methods for myometrium closure and other factors impacting effects on cesarean section scars of the uterine segment detected by the ultrasonography. Acta Obstet Gynecol Scand 2006; 85: 429434.
Higham JM, O'Brien PM, Shaw RW. Assessment of menstrual blood loss using a pictorial chart. Br J Obstet Gynaecol 1990; 97: 734739.
Iannone P, Nencini G, Bonaccorsi G, Martinello R, Pontrelli G, Scioscia M, Nappi L, Greco P, Scutiero G. Isthmocele: From Risk Factors to Management. Rev Bras Ginecol Obstet. 2019 Jan 15.
Jordans IPM, de Leeuw RA, Stegwee SI, Amso NN, Barri?Soldevila PN, van den Bosch T, Bourne T, Brölmann HAM, Donnez O, Dueholm M, Hehenkamp WJK, Jastrow N, D. Jurkovic D, Mashiach R, Naji O, Streuli I, Timmerman D, van der Voet LF, Huirne JAF. Sonographic examination of uterine niche in non?pregnant women: a modified Delphi procedure. Ultrasound in Obstetrics & Gynecology 2018; 53 (1):107-115.
Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gøtzsche PC, Ioannidis JP, Clarke M, Devereaux PJ, Kleijnen J, Moher D. The PRISMA statement for reporting systematic reviews and metaanalyses of studies that evaluate healthcare interventions: explanation and elaboration. BMJ 2009; 339: b2700.
MacDorman MF, Menacker F, Declercq E. Cesarean birth in the United States: epidemiology, trends, and outcomes. Clin Perinatol 2008; 35: 293307.
Menada Valenzano M, Lijoi D, Mistrangelo E, Costantini S, Ragni N. Vaginal ultrasonographic and hysterosonographic evaluation of the low transverse incision after caesarean section: correlation with gynaecological symptoms. Gynecol Obstet Invest 2006; 61: 216222.
Monteagudo A, Carreno C, Timor?Tritsch IE. Saline infusion sonohysterography in nonpregnant women with previous cesarean delivery: the niche in the scar. J Ultrasound Med 2001; 20: 11051115.
Morris H. Surgical pathology of the lower uterine segment caesarean section scar: is the scar a source of clinical symptoms? Int J Gynecol Pathol 1995; 14: 1620.Notzon FC, Placek PJ, Taffel SM. Comparisons of national cesarean?section rates. N Engl J Med1987; 316: 386389.
Naji O, Abdallah Y, Bij De Vaate AJ, Smith A, Pexsters A, Stalder C, McIndoe A, Ghaem?Maghami S, Lees C, Brolmann HA, Huirne JA, Timmerman D, Bourne T. Standardized approach for imaging and measuring Cesarean section scars using ultrasonography. Ultrasound Obstet Gynecol 2012; 39: 252259.
OfiliYebovi D, BenNagi J, Sawyer E, Yazbek J, Lee C, Gonzalez J, Jurkovic D. Deficient lowersegment Cesarean section scars: prevalence and risk factors. Ultrasound Obstet Gynecol 2008; 31: 7277.
Osser OV, Jokubkiene L, Valentin L. Cesarean section scar defects: agreement between transvaginal sonographic findings with and without saline contrast enhancement. Ultrasound Obstet Gynecol 2010; 35: 7583.
Osser OV, Jokubkiene L, Valentin L. High prevalence of defects in Cesarean section scars at transvaginal ultrasound examination. Ultrasound Obstet Gynecol 2009; 34: 9097.
Raimondo G, Grifone G, Raimondo D, Seracchioli R, Scambia G, Masciullo V. Hysteroscopic treatment of symptomatic cesarean-induced isthmocele: a prospective study. J Minim Invasive Gynecol 2015; 22 (02) 297-301
Regnard C, Nosbusch M, Fellemans C, Benali N, van Rysselberghe M, Barlow P, Rozenberg S. Cesarean section scar evaluation by saline contrast sonohysterography. Ultrasound Obstet Gynecol2004; 23: 289292.
Roberge S, Demers S, Berghella V, Chaillet N, Moore L, Bujold E. Impact of single- vs double-layer closure on adverse outcomes and uterine scar defect: a systematic review and metaanalysis. Am J Obstet Gynecol 2014; 211 (05) 453-460.
Roberge S. et al. Systematic review of cesarean scar assessment in the nonpregnant state: imaging techniques and uterine scar defect. Am. Journal Perinatol. 2012 Jun; 29(6):465-471.
Rodger SK et al. Imaging after cesarean delivery: acute and chronic complications. Radiographics. 2012 Oct; 32(6):693-712.
Setubal A, Alves J, Osório F. , et al. Treatment for uterine isthmocele, a pouch-like defect at the site of cesarean section scar. J Minim Invasive Gynecol 2018; 25 (01) 38-46
Thurmond AS, Harvey WJ, Smith SA. Cesarean section scar as a cause of abnormal vaginal bleeding: diagnosis by sonohysterography. J Ultrasound Med 1999; 18: 1316.
Tower AM, Frishman GN. Cesarean scar defects: an underrecognized cause of abnormal uterine bleeding and other gynecologic complications. J Minim Invasive Gynecol 2013; 20 (05) 562-572
Tulandi T, Cohen A. Emerging manifestations of cesarean scar defect in reproductive women. J Minim Invasive Gynecol 2016; 23 (06) 893-902
Uppal T, Lanzarone V, Mongelli M. Sonographically detected caesarean section scar defects and menstrual irregularity. J Obstet Gynaecol 2011; 31: 413416.
Vervoort AJ, Uittenbogaard LB, Hehenkamp WJ, Brölmann HA, Mol BW, Huirne JA. Why do niches develop in Caesarean uterine scars? Hypotheses on the aetiology of niche development. Hum Reprod 2015; 30 (12) 2695-2702
Vikhareva Osser O, Valentin L. Risk factors for incomplete healing of the uterine incision after caesarean section. BJOG 2010; 117: 11191126.
Vikhareva Osser O, Jokubkiene L, Valentin L. Cesarean section scar defects: agreement between transvaginal sonographic findings with and without saline contrast enhancement. Ultrasound Obstet Gynecol 2010; 35: 7583.
Wang CB, Chiu WW, Lee CY, Sun YL, Lin YH, Tseng CJ. Cesarean scar defect: correlation between Cesarean section number, defect size, clinical symptoms and uterine position. Ultrasound Obstet Gynecol 2009; 34: 8589.
Aggiornamenti
- Patologie Genetiche dello Scheletro
Sono elencate tutte le 436 Displasie Scheletriche con la... - Consigli per l'utilizzo del software diagnosi in Diagnosi...
Consigli per l'utilizzo del software diagnosi in Diagnosi... - TERMINI DI USO DEL PORTALE WEB med2000eco e Software...
TERMINI DI USO DEL PORTALE WEB med2000eco e Software...